در هر اندازه گیری به تعریف واحدهای اندازه گیری برای نشان دادن میزان یا مقدار پارامتر اندازه گیری شونده (measurand) نیاز است. غلظت پارامتر اصلی در اندازه گیری کمی است. بنابراین واحدهای غلظت نیز از پارامترهای پرکاربرد در بیان غلظت انواع اندازه گیری ها هستند. واحدهای مختلفی هم برای بیان و گزارش غلظت پیشنهاد شده و استفاده می شود. کاربرد انواع مختلف واحدهای غلظت مختلفی به نوع آنالیز و مقدار حل شده در محلول بستگی دارد.
غلظت اجزاء یک محلول معیاری از ترکیب آن است. برای یک نمونه مقدار مقدار حل شونده (solute) در واحد حجم محلول (solution) یا واحد جحم حلال (solvent) را غلظت (concentration) می گویند. غلظت هم می تواند به صورت کمی بیان شود و هم کیفی. به عنوان مثال وقتی می گوییم محلول رقیق (dilute) است یعنی مقدار نسبتا کمی از حل شونده در محلول وجود دارد و وقتی می گوییم محلول غلیظ (concentrated) است یعنی مقدار نسبتا زیادی از حل شونده در محلول وجود دارد. اما این روش در روش های آنالیزی پذیرفته شده نیست. در یک روش آنالیز کمی مقدار دقیق حل شونده موردنظر اندازه گیری و گزارش می شود. بنابراین واحدهای غلظت (Units of Concentration) در رشته های مختلف متفاوت است. در بعضی رشته ها و یا روش های آنالیزی از بعضی از این واحدها بیشتر استفاده می شود. به عنوان مثال در اندازه گیری های کمی در نمونه های زمین شناسی معمولا از واحد درصد وزنی استفاده می شود در صورتی که در اندازه گیری آلاینده های محیط زیستی یا مواد غذایی از واحدهای ppm و ppb بیشتر به کار می روند.
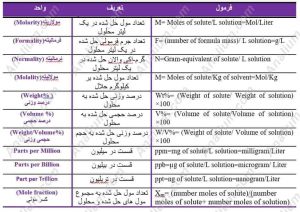
انواع واحدهای غلظتی تعریف آنها و نحوه محاسبه انواع واحدهای غلظتی
مولاریته
مولاریته یا غلظت مولار یکی از پرکاربردترین واحدهای غلظت است که نسبت تعداد مولهای یک حلشونده به یک لیتر محلول تعریف می شود. از این واحد در رقیق سازی محلول ها بسیار استفاده می شود. توجه کنید که هر مول ماده برابر با وزن اتمی آن ترکیب است.
M=تعداد مول حل شونده/ لیتر محلول
فرمالیته
فرمالیته یا غلظت فرمال تعداد فرمول گرم یک ماده در یک لیتر محلول است. برای بسیاری از مواد فرمالیته با مولاریته یکی است اما برای ترکیبات یونی که در محلول تفکیک می شوند متفاوت است. تفاوت اصلی فرمالیته و مولاریته در این است که مولاریته غلظت یک گونه ویژه را در یک محلول نشان می دهد اما فرمالیته غلظت کل گونه در محلول را نشان می دهد. مثلا با حل شدن ا مول NaCl در آب غلظت یون های Cl- و Na+ در آب 1 مولار است اما از آنجایی که تفکیک کامل صورت گرفته غلظت NaCl صفر مولار است. ولی فرمالیته NaCl برابر 1 خواهد بود.
مولالیته
مولالیته یا یا غلظت مولال تعداد مول های حل شونده در یک کیلوگرم حلال تعریف شده است. اگرچه کاربرد مولاریته بسیار بیشتر از مولالیته است اما مولالیته واحد دقیق تریست و مستقل از تغییرات دمایی ست در صورتی که تغییرات دما باعث تغییر در مولاریته و نرمالیته می شود.
نرمالیته
نرمالیته یا غلظت نرمال طبق تعریف مقدار گرم حلشونده – یا تعداد مول اکیوالان – در یک لیتر محلول است. اکی والان یا ارزگرم یک ماده برحسب نوع واکنش تعیین می شود.به عنوان مثال در واکنش خنثی شدن یک اسید اکی والان به صورت تعداد گرم هایی از هر ماده که در واکنش های شیمیایی معادل یک گرم هیدروژن عمل نماید تعریف می شود
حجم محلول (لیتر) / تعداد گرم اکیوالان = نرمالیته
وزن اکیوالان محلول / وزن حلشونده = تعداد گرم اکیوالان
نرمالیته از واحدهای مهم در انواع روش های تیتراسیون است. و رابطه مستقیم با مولاریته دارد. رابطه بین نرمالیته و مولاریته یک ماده با رابطه زیر به دست می آید.
حجم محلول (لیتر) × تعداد مول حلشونده = مولاریته (M)
درصد وزنی/ وزنی (W%)
این واحد برای اندازه گیری مقدار یک جامد در مایع یا محلول واحد مناسبی ست. درصد وزنی/ وزنی (W%) با رابطه زیر به دست می آید:
W%=[(وزن حل شده)/(وزن محلول)]×100
درصد وزنی معمولا در صنایع شیمیایی کاربرد بیشتری دارد مثلا مایع سفیدکننده با 3% هیپوکلریت سدیم. دقت کنید درصد جرمی معادل درصد وزنی است.
با دانستن چگالی یک ماده مایع و تبدیل حجم به جرم به راحتی می توان درصد وزنی را برای مایعات نیز به دست آورد (حجم/جرم=چگالی)
توجه شود که وزن محلول از مجموع وزن حلال و وزن حل شونده به دست می آید.
درصد حجمی/حجمی (V%)
این واحد برای اندازه گیری مقدار یک مایع در مایع یا محلول واحد مناسبی ست. درصد حجمی/حجمی (V%) با رابطه زیر به دست می آید:
V%=[(حجم حل شده)/( حجم محلول)]×100
درصد وزنی/حجمی (W/V%)
این واحد اندازه گیری غلظت تغییرات وزن حل شده به حجم محلول را نشان می دهد. درصد وزنی/حجمی (W/V%) با رابطه زیر به دست می آید:
W/V%=[( وزن حل شده)/( حجم محلول)]×100
توجه شود که واحد وزن گرم و واحد حجم میلی لیتر است. اگرچه به علت استفاده از دو واحد متفاوت این رابطه صحیح به نظر نمی رسد اما یک واحد اندازه گیری سریع و آسان غلظت است که در داروسازی زیاد به کار می رود.
قسمت در میلیون
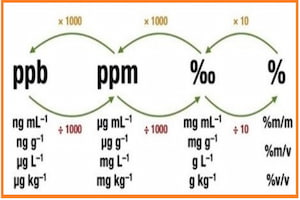
قسمت در میلیون (Parts per Million) با نام اختصاری و شناخته شده ppm در مواقعی استفاده می شود که مقدار حل شونده در حد جزیی (trace) باشد. رابطه های زیر نحوه محاسبه ppm را نشان می دهد:
1ppm = 1/1000000 = 0.000001 = 1×10-6
1ppm = 0.0001%
C(ppm) = msolute (mg) / Vsolution (l)
C(ppm) = msolute (mg) / msolution (kg)
ppm=(وزن حل شده بر حسب میلی گرم)/( حجم محلول برحسب لیتر)
قسمت در بیلیون
قسمت در بیلیون (Parts per Billion) با نام اختصاری و شناخته شده ppb در مواقعی استفاده می شود که مقدار حل شونده در حد جزیی (trace) باشد. رابطه های زیر نحوه محاسبه ppb را نشان می دهد:
ppb=(وزن حل شده بر حسب میکرو گرم)/( حجم محلول برحسب لیتر)
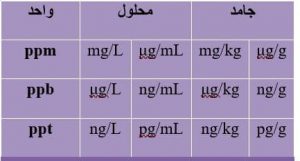
جدول دو رابطه ppm ppb و ppt با واحدهای غلظتی را در مواد محلول و یا جامد را نشان می دهد.
رابطه ppm ppb و ppt با واحدهای غلظتی