فاز متحرک در کروماتوگرافی مایع با کارایی بالا یا HPLC علاوه بر انتقال نمونه و عبور آن از ستون جداسازی و متعاقباً به آشکارساز برای شناسایی اجزای جدا شده نقشی مهم در فرایند جداسازی اجزاء مخلوط در همراهی با فاز ثابت (ستون کروماتوگرافی) دارد.
انواع فاز متحرک در HPLC
حلال های مورد استفاده در HPLC بر اساس نوع فاز ساکن مورد استفاده انتخاب می شوند. براساس قطبیت نسبی فاز ساکن و متحرک
و نوع کروماتوگرافی فاز نرمال و کروماتوگرافی فاز معکوس قابل اجرا می باشد. در کروماتوگرافی فاز نرمال از حلال های غیر قطبی مانند کلروفرم، سیکلوهگزان، بنزن، تتراکلرید کربن و … استفاده می شود. کاربرد کروماتوگرافی فاز نرمال خیلی محدودتر از فاز معکوس می باشد.
فاز متحرک در HPLC فاز معکوس به ندرت یک حلال منفرد است. عموما از ترکیب آب با حلال های آلی، بافرهای آبی با حلال های قطبی یا مخلوطی از حلال های آلی به نسبت دلخواه تشکیل شده است.
انواع شویش در HPLC
دو حالت عملیاتی که معمولاً مورد استفاده قرار می گیرند:
حالت ایزوکراتیک:در حالت ایزوکراتیک ترکیب فاز متحرک در طول آنالیز ثابت می ماند، یعنی در مورد نسبت حلالها در مخلوط از قبل تصمیم گرفته شده است و در طول آنالیز بدون تغییر باقی می ماند.
حالت گرادیانت:در این حالت ترکیب درصد فاز متحرک در طی آنالیز تغییر می کند و این تغییر در ترکیب درصد با کمک نرم افزار دستگاه اعمال می شود.
هدف استفاده از مخلوط های حلال مختلف دستیابی به فاز متحرک مناسب برای اختلاط کامل نمونه و کنترل برهم کنش اجزاء نمونه با فاز ثابت برای دستیابی به درجه مطلوب تفکیک اجزاء در کمترین زمان ممکن است.
برای دستیابی به اهداف مورد نیاز، فاز متحرک باید دارای ویژگی های اساسی زیر باشد:
- حلال های مورد استفاده (آب، محلول بافر یا حلال آلی) در HPLC باید عاری از ذرات معلق باشد. حذف ذرات معلق احتمالی با فیلتر کردن حلال قبل از استفاده انجام می شود.
- نمونه باید در فاز متحرک کاملاً محلول باشد. هرگونه عدم انحلال منجر به محدودیت در جریان فاز متحرک می شود. حلالیت نمونه را همیشه قبل از تزریق به سیستم در فاز متحرک بررسی کنید.
- فاز متحرک نباید هیچ گونه برهم کنش و اثری نسبت به ترکیبات نمونه و فاز ساکن داشته باشد. هرگونه واکنش می تواند منجر به تشکیل سوسپانسیون های نامحلول شود که می تواند منجر به انسداد ستون شود.
- فاز متحرک نباید هنگام عبور از آشکارساز منجر به پاسخ دهی آن شود. به عبارت دیگر سیگنال های آشکارساز باید فقط پاسخ اجزاء موجود در نمونه را منعکس کنند.
- فاز متحرک باید مقرون به صرفه باشد و نسبت حلال های استفاده شده باید از نظر اقتصادی آنالیز را مقرون به صرفه کند.
- در صورت استفاده از بافرها، همیشه pH فاز آبی را قبل از مخلوط کردن با فاز آلی تنظیم کنید.
در ادامه مواردی درباره محلول های مورد استفاده به عنوان فاز متحرک در HPLC فاز معکوس ارائه می شود.
تهیه محلول های بافر
pH فاز متحرک برای بهبود جداسازی اجزا و افزایش عمر ستون تنظیم می شود. این تنظیم pH باید تا آنجا که ممکن است به گونه ای باشد که به سادگی در مواجه با نمونه اسیدی یا قلیایی تغییر نکند و در مقابل تغییر pH مقاومت داشته باشد یعنی از محلول های بافر استفاده شود. در صورت عدم استفاده از محلول های بافر، ممکن است در جداسازی شاهد تکرارپذیری مناسب نباشیم.
یک محلول بافر به صورت ترکیبی از اسیدهای ضعیف و نمک های آنها (نمک های سدیم و غیره) یا باز های ضعیف و نمک های آنها تهیه می شود. روشهای معمول آماده سازی عبارتند از:
1) اضافه کردن اسید (یا باز) به محلول آبی نمک در حالی که pH را با pH متر اندازه گیری می کنید.
2) ساخت محلول آبی اسید و محلول آبی نمک مربوطه و مخلوط کردن آنها هنگام اندازه گیری PH با pH متر.
با این حال، اگر از محلول بافر به عنوان یک فاز متحرک HPLC استفاده شود، حتی اشتباهات جزئی در pH می تواند منجر به ایجاد مشکل در تکرارپذیری جداسازی شود. بنابراین، مهم است که با دقت انجام شود و از عملکرد صحیح PH متر مورد استفاده اطمینان داشت.
مواردی که در مورد محلول بافر مورد استفاده در فاز متحرک HPLC باید به آن توجه کرد.
- حداکثر عملکرد بافر نزدیک به pKa اسید (یا باز) می باشد
برای مثال، هنگامی که محلول بافر اسید استیک (سدیم) از نسبت 1: 1 اسید استیک و سدیم استات تهیه می شود، pH محلول بافر تقریباً 4.7 است (نزدیک pKa اسید استیک)، و در اینجاست که می توان حداکثر عملکرد بافر را بدست آورد .
- با افزایش غلظت، ظرفیت بافر افزایش می یابد
به عنوان مثال، ظرفیت بافر محلول بافر اسید استیک (سدیم) در غلظت 100 میلی مولار بیشتر از 10 میلی مولار است،. با این حال باید توجه داشت که، رسوب در غلظت های بالاتر با سهولت بیشتری رخ می دهد.
- به انحلالیت نمک و احتمال رسوب کردن آن توجه داشته باشید
حلالیت نمک به نوع نمک مانند نمک پتاسیم یا نمک سدیم بستگی دارد. نمکها وقتی که با یک حلال آلی مخلوط می شود به راحتی رسوب می کنند.
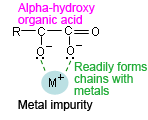
- علاوه بر این، تا آنجا که ممکن است از استفاده از محلول های بافر مبتنی بر اسیدهای آلی (اسید کربوکسیلیک) برای آنالیز های بسیار حساس در طول موج کوتاه UV خودداری کنید. شرایط آنالیزی مختلف را در نظر بگیرید و از یک محلول بافر مناسب استفاده کنید. به عنوان نمونه اسید آلی با گروه هیدروکسیل در موقعیت α اثرات یونهای ناخالصی فلز را محدود می کند. یک اسید آلی با گروه هیدروکسیل (اسید سیتریک، اسید تارتاریک و غیره) در موقعیت α دارای ساختاری است که به راحتی با ناخالصی های فلزی در فاز متحرک پیوند تشکیل می دهد.
روش تهیه فاز متحرک در HPLC و اثر آن روی کروماتوگرام
همانطور که گفته شد عموما از آب، محلول بافر، حلال آلی یا مخلوطی از آنها به عنوان فاز متحرک در HPLC استفاده می شود. یک محلول بافر اغلب به عنوان حلال آبی استفاده می شود.
اگر روش تهیه فاز متحرک مشابه روش توصیف شده در روش آنالیز نباشد، این تفاوت در تهیه می تواند موجب تغییر در کروماتوگرام ها (شکل کروماتوگرام و زمان بازداری ها) و در نهایت تأثیر در نتایج آنالیز می شود. به غیر از محلول بافر، بسیاری از عوامل پیش بینی نشده دیگر مانند روش مخلوط کردن حلال روی آماده سازی فاز متحرک تأثیر می گذارند.
به عنوان نمونه تهیه “محلول بافر فسفات 20 میلی مولار ” (pH = 2.5) را در نظر بگیرید.
ما می دانیم که این یک محلول بافر اسید فسفریک است، اما یون زوج شده با آنیون فسفات چیست؟ اگر یون های سدیم باشند، “20 میلی مول” به غلظت اسید فسفریک یا غلظت سدیم فسفات اشاره دارد؟
برای این محلول بافر فسفات20 میلی مولار (سدیم)، “20 میلی مولار” می تواند غلظت اسید فسفریک در نظر گرفته شود. از طرف دیگر، اگر “20 میلی مولار” به عنوان غلظت سدیم فسفات در نظر گرفته شود، محلول بافر می تواند یک محلول بافر تهیه شده با استفاده از محلول آبی 20 میلی مولار سدیم دی هیدروژن فسفات باشد که pH آن تنظیم شده است. (محلول آبی 20 میلی مولار سدیم دی هیدروژن فسفات دارای pH کمی کمتر از 5 است، بنابراین تنظیم PH با برخی از انواع اسید برای دستیابی به pH 2.5 مورد نیاز است)
نوع اسید مورد استفاده برای تنظیم pH به دلیل اثر زوج یونی، می تواند بر نتایج آنالیز تأثیر بگذارد. این موضوع به دلیل اینکه می تواند منجر به تفسیرهای مختلف در مورد کروماتوگرام های حاصل شود باید مورد توجه قرار داده شود.
مثال فوق منجر به سه تفسیر بالقوه می شود. شکل 1 نشان می دهد که چگونه این موضوع روی نتایج آنالیز تأثیر می گذارد.
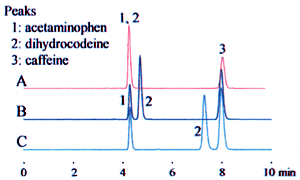
شکل 1 اثر روش های مختلف تهیه بافر روی کروماتوگرام
کروماتوگرام ردیف بالا (قرمز)، “20 میلی مولار” به عنوان غلظت اسید فسفریک تفسیر می شود. نتایج آنالیز با استفاده از یک حلال تهیه شده به عنوان “محلول بافر 20 میلی مولار اسید فسفریک (سدیم) (pH 2.5)” به عنوان فاز متحرک به دست آمد.
در ردیف های میانی و پایینی، “20 میلی مولار” به غلظت سدیم دی هیدروژن فسفات تعبیر می شود. فاز متحرک با افزودن اسید فسفریک یا اسید پرکلریک برای تنظیم pH به 2.5 تهیه شد.
این تفاوت ها می تواند به طور قابل توجهی بر زمان بازداری تأثیر بگذارد، همانطور که برای دی هیدروکودئین در مثال نشان داده شده است، و می تواند منجر به مشکلاتی در استحکام (robustness) روش آنالیز شود. مشخص بودن شیوه تهیه محلول بافر می تواند از مشکلات ناشی از اختلاف در تفسیر جلوگیری کند.
مخلوط حلالی آلی-آبی
به عنوان فاز متحرک در HPLC فاز معکوس اغلب از یک محلول مخلوط از حلال های آلی و حلال های آبی استفاده می شود. نحوه مخلوط کردن آنها می تواند اختلاف زیادی در نتایج آنالیز ایجاد کند. مثالی از محلول بافر 90٪ و استونیتریل 10٪ را در نظر بگیرید. (محلول بافر 20 میلی مولار دی هیدروژن فسفات سدیم است که با افزودن اسید فسفریک در pH 2.5 تنظیم می شود.) نسبت اختلاط 9: 1 را می توان به عنوان نسبت حجمی 9: 1 محلول بافر و استونیتریل تفسیر کرد. یعنی حجم های معادل آن اندازه گیری و با هم مخلوط می شوند.
از طرف دیگر، می توان این را به عنوان 10٪ استونیتریل تفسیر کرد، به این معنی که استونیتریل باید ده بار با محلول بافر رقیق شود یا به عبارت دیگر برای تهیه 100 میلی لیتر از این مخلوط حلالی 10 میلی لیتر استونیتریل را درون یک بالن حجمی 100 بریزیم و تا خط نشانه با بافر به حجم برسانیم. در این حالت با توجه به کاهش حجم به دلیل اختلاط، محلول بافر بیشتری اضافه می شود. ممکن است احساس شود که تفاوت زیادی بین این دو وجود ندارد. به این موضوع باید دقت شود، زیرا نوع اختلاط می تواند تأثیر قابل توجهی در نتایج آنالیز (به ویژه زمان بازداری) داشته باشد، همانطور که در شکل 2 نشان داده شده است.
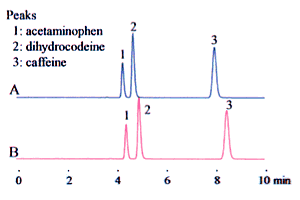
به طور کلی، هنگام آماده سازی فاز متحرک در HPLC، این نسبت اغلب به صورت (A : B = 3: 2 (V / V نشان داده می شود. یعنی معادل نسبت حجمی 3 از مایع A و معادل نسبت حجمی 2 از مایع B جداگانه اندازه گیری شده و با هم مخلوط می شوند. (در عمل، این باعث می شود که حجم مخلوط کمی کمتر از معادل کل تئوری “5” برای دو مایعات باشد (3 + 2)).