روشهای آزمون برای آنالیز مواد مختلف شامل مواد اولیه، مواد واسطهای، محصولات نهایی، نمونه های زیست محیطی، مواد غذایی و … با استفاده از تکنیکهای آنالیزی مختلف مانند تیترومتری، طیفسنجی، کروماتوگرافی، پلاروگرافی، الکتروفورز و غیره توسعه داده (develop) میشوند. برای اطمینان از مناسب بودن روش آزمون برای هدف مورد نظر نیاز به اعتبارسنجی روش آزمون می باشد.
اعتبارسنجی روش آزمون
اعتبارسنجی روش آزمون فرآیندی است که در آن فرد مشخص می کند که پروتکل آزمون برای هدف آنالیز مورد نظر خود مناسب است. برخی از اهداف عبارتند از:
1- تعیین کنید چه مقدار از یک ماده ارزشمند، ضروری یا خاص در یک محصول وجود دارد.
2- تعیین اینکه آیا یک محصول با مشخصات مطابقت دارد یا خیر.
3- تعیین اینکه آیا یک محصول الزامات نظارتی را برآورده می کند یا خیر.
4- بررسی یک محیط برای تعیین وجود و مقدار یک جزء، آلاینده، یا یک ماده مغذی.
5- یک محصول و/یا اجزای آن را شناسایی کنید.
اهداف معمولاً به این سؤال پاسخ می دهند که “این محصول چیست؟” یا به بیان دیگر، مشخص کردن هویت شیمیایی یا اجزای آن، اینکه چقدر از چیزی (آنالیت) در این محصول (ماتریس) وجود دارد؟
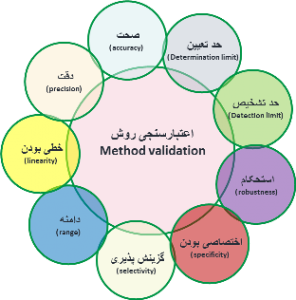
پارامترهای اعتبارسنجی روش آزمون
برای تعیین اینکه آیا روش می تواند برای هدف مورد نظر خود استفاده شود یا خیر، ویژگی های عملکرد مورد نیاز است. هدف آنالیز تعیین می کند که کدام ویژگی مهم و کدام یک ممکن است دارای اهمیت کمتر باشد.
ICH، FDA و USP ویژگی های عملکرد روش آزمون برای تایید را به صورت صحت، دقت (تکرارپذیری، دقت متوسط و تکثیرپذیری)، اختصاصی بودن، حد تشخیص، حد تعیین، خطی بودن و استحکام تعریف میکنند.
در ادامه برخی پارامترهایی اعتبارسنجی روش آزمون همراه با توضیح مختصر در مورد آنها آورده شده است.
صحت (accuracy)
صحت یک روش آنالیز به این صورت تعریف می شود که نتایج آزمون پارامترها برای یک آنالیت خاص چقدر به مقدار واقعی این پارامترها نزدیک است. در مورد آنالیز مقادیر کم، صحت را می توان از طریق آنالیز یک ماده مرجع تایید شده، مقایسه با داده های به دست آمده با یک روش معتبر مستقل، یا مقایسه بین آزمایشگاهی با یک آزمایشگاه معتبر دارای گواهی صلاحیت آزمایشگاه های آزمایش و کالیبراسیون مطابق با ISO/IEC 17025 تعیین کرد. همچنین صحت را می توان از طریق آزمایش های بازیابی (راندمان) نمونه آلوده شده (spiked sample) و استفاده از روش افزایش استاندارد تعیین کرد.
به عنوان مثال هنگامی که قرار است یک ماده دارویی مورد سنجش قرار گیرد، صحت را می توان با اعمال روش آنالیز برای یک آنالیت با خلوص شناخته شده یا مقایسه نتایج روش با نتایج یک روش دوم با مشخصه، که صحت آن بیان شده است، تعیین کرد. در موردی که در آن یک دارو در یک محصول فرموله شده باید مورد سنجش قرار گیرد، صحت را می توان با آنالیز مخلوط های مصنوعی اجزای دارو که مقادیر مشخصی از آنالیت در طول فرآیند به آن اضافه شده است، تعیین کرد. برای آنالیز کمی ناخالصیها، میتوان صحت را روی نمونههایی که دارای مقادیر مشخصی از ناخالصیها هستند ارزیابی کرد. صحت بهعنوان درصد بازیابی با سنجش مقدار مشخص افزوده شده آنالیت در نمونه، یا به عنوان تفاوت بین میانگین و مقدار واقعی پذیرفتهشده، همراه با فواصل اطمینان محاسبه میشود.
دقت (precision)
دقت یک روش آنالیز (که با انحراف استاندارد یا انحراف استاندارد نسبی اندازهگیری میشود) درجه توافق بین نتایج آزمایش فردی است زمانی که این روش به طور مکرر برای نمونهبرداریهای متعدد از یک نمونه همگن اعمال میشود.
دقت را می توان به صورت زیر بیان کرد:
تکرارپذیری، یا دقت درون سنجش (به عنوان معیاری از دقت در شرایط عملیاتی مشابه در یک بازه زمانی کوتاه).
دقت متوسط در تغییرات آزمایشگاهی (روزهای مختلف، تحلیلگران مختلف و تجهیزات مختلف)؛
و تکثیرپذیری، که دقت بین آزمایشگاهی است.
دقت در یک آزمایشگاه یا تکرارپذیری در ابتدا می تواند بر اساس یک نمونه همگن باشد و به عنوان انحراف استاندارد بیان می شود.
گزینش پذیری (selectivity)
گزینش پذیری توانایی متمایز کردن اجزای یک مخلوط از یکدیگر است.
بر اساس IUPAC، گزینش پذیری معیاری است که نشان می دهد می توان از یک روش برای تعیین آنالیت های خاص در مخلوط ها یا ماتریس ها بدون تداخل سایر اجزای دارای رفتار مشابه استفاده کرد.
اختصاصی بودن (specificity)
اختصاصی بودن توانایی ارزیابی دقیق جزء در یک مخلوط است.
اختصاصی بودن توانایی اندازه گیری بدون ابهام آنالیت در حضور سایر اجزاء مانند ناخالصی ها، محصولات تخریب و اجزای ماتریس است. در مورد آنالیز کم مقدار (trace analysis) و در زمینه طیفسنجی نشری پلاسما-نوری جفت شده القایی (ICP-OES) و طیفسنجی جرمی پلاسما جفت شده القایی (ICP-MS)، اختصاصی بودن را میتوان با تأیید موثر نبودن تداخل در فرآیند اندازهگیری ارزیابی کرد. مطالعات تداخل طیفی که بر اساس آنالیزهای تک آنالیت پایه گذاری شده اند، عموماً مبنایی برای ارزیابی اختصاصی بودن هستند، و تهیه ماتریس های مصنوعی که با دقت طراحی شده و بافت آن مشابه نمونه های مورد مطالعه می باشد، به ویژه هنگام ارزیابی اختصاصی بودن روش، برای انواع نمونه های پیچیده مفید است.
حد تشخیص(Detection limit)
بر اساس توصیه های IUPAC، حد تشخیص حداقل غلظتی است که می توان به طور قابل اعتماد توسط روش تشخیص داد. این اندازه گیری را می توان با استفاده از چندین روش تعیین کرد، بسته به اینکه این روش غیر دستگاهی یا دستگاهی باشد. که می توانند بر اساس ارزیابی بصری، نسبت سیگنال به نویز، انحراف استاندارد پاسخ و شیب پاسخ دستگاه باشند.
در مورد آنالیز کم مقدار، حد تشخیص به صورت SD0 3 تعریف میشود، که در آن SD0 مقدار انحراف استاندارد با نزدیک شدن غلظت آنالیت به 0 است. مقدار SD0 را میتوان با برون یابی از نمودار انحراف استاندارد در مقابل غلظت به دست آورد. که در آن سه سطح غلظت که در نواحی مورد نظر کم، متوسط و زیاد هستند با استفاده از ماتریسی که با ماتریس نمونه مطابقت دارد، هر کدام حدود 11 بار آنالیز میشوند.
حد تعیین (Determination limit)
حد تعیین، کمترین مقدار آنالیت در یک نمونه است که با دقت و صحت قابل قبولی قابل تعیین است. همانند حد تشخیص، بسته به اینکه این روش دستگاهی یا غیر دستگاهی باشد، می توان از روش های متعددی استفاده کرد. اینها میتوانند بر اساس ارزیابی بصری، سیگنال به نویز، انحراف استاندارد پاسخ و شیب، انحراف استاندارد شاهد و منحنی کالیبراسیون باشند.
در مورد آنالیز کم مقدار، حد تعیین به عنوان SD0 10 با عدم قطعیت حدود 30٪ در سطح اطمینان 95٪ تعریف می شود.
خطی بودن (linearity)
خطی بودن، رابطه غلظت و شاخصه مورد اندازهگیری در محدوده روش آنالیز را نشان می دهد. در اعتبارسنجی، اگر خطی بودن قابل دستیابی نباشد، می توان از مدل غیرخطی استفاده کرد. هدف این است که یک مدل خطی یا غیرخطی داشته باشیم که رابطه غلظت-اندازه گیری را توصیف کند.
در مورد آنالیز کم مقدار، خطی بودن خاصیتی است که بین حد تعیین و نقطه ای است که نمودار غلظت در مقابل پاسخ غیرخطی می شود.
دامنه (range)
دامنه یا محدوده فاصله بین غلظت (مقدار) بالا و پایین آنالیت در نمونه است که در آن روش آنالیز سطح مناسبی از صحت، دقت و خطی بودن را دارا می باشد.
برای آنالیز کم مقدار، محدوده بین حد تعیین و نقطه ای است که نمودار غلظت در مقابل پاسخ غیرخطی می شود را شامل می شود.
استحکام (robustness)
استحکام ظرفیت یک روش برای بیتأثیر ماندن از تغییرات عمدی در پارامترهای روش است.
به عنوان مثال در مورد آنالیز کم مقدار با استفاده ازICP، پارامترهای استحکام شامل دما (آزمایشگاه و محفظه اسپری)، غلظت معرفها، قدرتRF، نبولایزر، محفظه اسپری، طراحی مشعل، ارتفاع مشعل، نمونهگیر و مخروط اسکیمر طراحی/مواد ساخت، زمان ادغام، طراحی آشکارساز، نوع یا شرایط سلول واکنش/برخورد، و قابلیت تفکیک. این پارامترها را می توان تغییر داد که بر قابلیت اطمینان اندازه گیری تأثیر می گذارد.
اهمیت اعتبارسنجی روش آزمون
اعتبارسنجی روش آزمون جنبه مهمی از انطباق با مقررات مختلف است. انطباق مستلزم آن است که اعتبار روش های آزمون قبل از معرفی آنها به عنوان روش معمول (routine) انجام شود. هر گاه شرایط آزمایشی که رویههای آزمون برای آنها تأیید شده است تغییر کند، تأیید روشهای آزمون باید دوباره انجام شود. پس از توسعه و تایید یک روش آزمون، باید گزارشی تهیه شود که شامل دامنه روش آزمون و روشهایی باشد که برای اعتبارسنجی آنها دنبال میشود. این گزارش معتبر بودن روش، بخشی از شواهد مستند برای نشان دادن انطباق با مقررات مؤثر بر رویه های آزمون و اینکه آنها برای هدف مورد نظر خود مناسب هستند، تبدیل می شود.
بنابراین، برای یک آزمایشگاه توصیه میشود که یک طرح جامع برای تأیید رویههای آزمون خود ایجاد کند تا از انطباق مداوم آن با مقررات و الزامات مختلف، اطمینان حاصل کند.
منابع
Eurachem Guide: The Fitness for Purpose of Analytical Methods. A Laboratory Guide to Method Validation and Related Topics, 1st edition, Eurachem, Dec. 1998.
ISO/IEC 17025: General Requirements for the competence of testing and calibration laboratories, November 2017.
https://www.fda.gov/downloads/drugs/guidances/ucm386366.pdf
https://hmc.usp.org/sites/default/files/documents/HMC/GCs-Pdfs/c1225_1SUSP40.pdf
http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q2_R1/Step4/Q2_R1__Guideline.pdf